Ароматические соединения - циклические органические соединения, которые имеют в своём составе ароматическую систему


Нефть представляет собой сложную смесь углеводородов. Дополнительно в состав нефти входит неуглеродная часть и минеральные примеси. Углеродная часть нефти состоит из парафиновых (алканы), нафтеновых (цикланы) и ароматических (арены) углеводородов.
Ароматические углеводороды (арены) имеют моноциклические (бензол, толуол, ксилолы) или би- и полициклические (нафталин, антрацен и др.) структуры. Их содержится в нефти 10 - 20 %.
Различают одноядерные (одна бензольная группировка в молекуле) и многоядерные ароматические углеводороды, содержащие две или более бензольные группировки. В молекулах аренов в качестве боковых цепей могут находиться углеводородные радикалы с неразветвлённой или разветвлённой углеродной цепочкой, а также содержащие двойные или тройные связи и циклические группировки:

Первый и один из наиболее важных представителей гомологического ряда одноядерных ароматических углеводородов – бензол С 6 Н 6 . Отсюда и общее название гомологического ряда – ряд бензола.
Строение бензола
Общая формула моноциклических аренов C n H 2 n -6 показывает, что они являются ненасыщенными соединениями.
Такая структура молекулы бензола не объясняла многие свойства бензола:
Для бензола характерны реакции замещения, а не присоединения, свойственные ненасыщенным соединениям. Реакции присоединения возможны, но протекают труднее, чем для алкенов.
Бензол не вступает в реакции, являющиеся качественными реакциями на непредельные УВ (с бромной водой и раствором KMnO 4).
Физические свойства
Физические свойства аренов связаны с числом атомов углерода, наличием заместителей и расположением их в молекуле. Арены имеют более высокие температуры кипения, чем соответствующие циклоалканы. Это объясняется плотной упаковкой их молекул, (плоское кольцо), а также более сильным физико- химическим взаимодействием между молекулами вследствие наличия π-электронов.
Гомологи с рядом расположенными алкильными заместителями кипят при более высоких температурах, чем n-изомеры.
Температуры плавления аренов тем выше, чем симметричнее расположены алкильные заместители. Это объясняется тем, что асимметрия затрудняет упорядочение вещества в твёрдом состоянии.
Увеличение числа циклов сопровождается повышением температуры плавления. Появление боковых цепей снижает температуру плавления, а удлинение цепи приводит к её повышению.
Для аренов характерны максимальные среди других углеводородов плотность и показатель преломления, что используется в аналитических целях.
Кроме того, арены отличаются от других углеводородов ярко выраженной способностью избирательно растворяться в некоторых растворителях. К таким избирательным (селективным) растворителям относятся полярные жидкости: сернистый ангидрид, диметилсульфат, сульфолан, ацетон, фенол, фурфурол, диэтиленгликоль, анилин, нитробензол и др.
Химические свойства и использование
Реакции присоединения. Арены вступают в реакции присоединения с большим трудом.
Реакции замещения наиболее характерны для аренов. Они протекают в сравнительно мягких условиях. Особенно легко вступают в реакции замещения гомологи бензола.
Галоидирование . В зависимости от условий галоидирования можно получить продукты различной степени замещения:


Сульфирование . Концентрированная серная кислота легко замещает водород на остаток серной кислоты с образованием сульфокислоты.
Эта реакция протекает количественно и может служить одним из способов определения содержания аренов в нефтяных фракциях.

Из бензолсульфокислоты и хлорбензола сплавлением их со щёлочью получают фенол.
Основная область применения фенола - производство фенолформальдегидных смол.
Нитрование . При действии на бензол смесью концентрированных азотной и серной кислот получается нитробензол:

Восстановлением нитробензола получают анилин:

Большая часть анилина используется для производства полиуретановых пенопластов.
При полном нитровании толуола получают взрывчатое вещество тротил (2,4,6-тринитротолуол):

Алкилирование . В присутствии таких катализаторов как АlCl 3 , HF, H 2 SO 4 , HCl, BF 3 арены вступают в реакцию алкилирования с алкенами, спиртами, галоидзамещёнными алканами. Таким способом в промышленности получают этилбензол и изопропилбензол:

Каталитическим дегидрированием из этилбензола получают стирол, а из изопропилбензола - -метилстирол - ценные мономеры, используемые в производстве каучуков и пластмасс:

Деалкилирование и гидродеалкилирование. В связи с тем, что наибольшее значение имеет бензол, его в настоящее время получают деалкилированием или гидродеалкилированием толуола:

Конденсация с формальдегидом . В присутствии концентрированной серной кислоты арены конденсируются с формальдегидом с образованием нерастворимого осадка бурого цвета:

Эту реакцию применяют для аналитического определения аренов в нефтяных фракциях.
Окисление . Арены (кроме бензола, нафталина и других голоядерных гомологов) легко вступают в реакции окисления. В ряду алкилпроизводных аренов устойчивость к окислению падает с увеличением длины и степени разветвления боковой цепи. При этом образуются кислые соединения. Эти свойства аренов широко используются в промышленности для получения кислородсодержащих производных:



С целью получения терефталевой кислоты разработаны также различные процессы окисления толуола. Наиболее устойчивыми к окислению кислородом воздуха являются бензол и нафталин. Однако и они в очень жёстких условиях (высокая температура, катализатор) окисляются с разрывом бензольного кольца:


Терефталевая кислота - полупродукт для производства синтетического полиэфирного волокна - лавсана (терилена). Фталевый ангидрид применяется для производства алкидных и полиэфирных смол, пластификаторов, репеллентов. Малеиновый ангидрид используется в производстве полиэфирных смол и присадок к смазочным маслам.
Образование комплексов с пикриновой кислотой. Полициклические арены (нафталин, антрацен и их гомологи) легко образуют комплексные соединения с пикриновой кислотой (2,4,6 - тринитрофенол) – пикраты.
Бензол и его гомологи не образуют стабильных комплексов и могут служить растворителями при комплексообразовании.
Пикраты ароматических углеводородов представляют собой твёрдые кристаллические вещества жёлтого цвета, имеющие чёткие температуры плавления. Каждому полициклическому углеводороду соответствует пикрат с определённой температурой плавления. По температуре плавления пикрата модно идентифицировать полициклический ароматический углеводород.
Комплексообразование с пикриновой кислотой используется как метод выделения полициклических ароматических углеводородов. Пикраты легко разлагаются горячей водой. Пикриновая кислота растворяется в воде, а полициклические ароматические углеводороды выделяются в свободном виде.
2.4.4. Углеводороды смешанного стороения
Высококипящие фракции нефти главным образом состоят в основном из углеводородов смешанного (гибридного) строения. Это полицикличекие углеводороды, молекулы которых содержат циклоалкановые структуры, конденсированные с аренами.
В керосино-газойлевых фракциях содержатся простейшие гибридные бициклические углеводороды и их гомологи:

Ареновые циклы гибридных углеводородов имеют преимущественно короткие (метильные или этильные) заместители, циклоалкановые кольца – один или два довольно длинных алкильных заместителя. Особенно много гибридных углеводородов в масляных фракциях. Строение их изучено мало.
Гибридные углеводороды являются нежелательными компонентами смазочных масел, поскольку они ухудшают вязкостные свойства и уменьшают стабильность их против окисления.
2.4.5. Арены нефти, влияние на свойства нефтепродуктов,
применение
Арены являются желательными компонентами карбюраторных топлив, так как обладают высокими октановыми числами (толуол -103, этилбензол - 98).
Присутствие аренов в значительных количествах в дизельном и реактивном топливах ухудшает условие сгорания, и поэтому крайне нежелательно.
Полициклические арены с короткими боковыми цепями ухудшают эксплуатационные свойства масел и поэтому они из них удаляются.
Арены являются ценным сырьём для нефтехимического синтеза, при производстве синтетических каучуков, пластмасс, синтетических волокон, анилино-красочных и взрывчатых веществ, фармацевтических препаратов. Наибольшее значение имеют бензол, толуол, ксилолы, этилбензол, нафталин.
Химия — очень увлекательная наука. Она изучает все вещества, которые существуют в природе, а их огромное множество. Они разделяются на неорганические и органические. В этой статье мы рассмотрим ароматические углеводороды, которые относятся к последней группе.
Что это такое?
Это органические вещества, которые имеют в своем составе одно или несколько бензольных ядер — устойчивых структур из шести атомов углерода, соединенных в многоугольник. Данные химические соединения обладают специфическим запахом, что можно понять из их названия. Углеводороды этой группы относятся к циклическим, в отличие от алканов, алкинов и др.
Ароматические углеводороды. Бензол
Это самое простое химическое соедиение из данной группы веществ. В состав его молекул входят шесть атомов углерода и столько же гидрогена. Все остальные ароматические углеводороды являются производными бензола и могут быть получены с его использованием. Это вещество при нормальных условиях находится в жидком состоянии, оно бесцветное, обладает специфическим сладковатым запахом, в воде не растворяется. Закипать оно начинает при температуре +80 градусов по Цельсию, а замерзать — при +5.
Химические свойства бензола и других ароматических углеводородов
Первое, на что нужно обратить внимание, — галогенирование и нитрование.
Реакции замещения
Первая из них — галогенирование. В этом случае, чтобы химическое взаимодействие могло осуществиться, нужно использовать катализатор, а именно трихлорид железа. Таким образом, если добавить к бензолу (С 6 Н 6) хлор (Cl 2), то мы получим хлорбензол (С 6 Н 5 Cl) и хлороводород (HCl), который выделится в виде прозрачного газа с резким запахом. То есть вследствие этой реакции один атом водорода замещается атомом хлора. То же самое может произойти и при добавлении к бензолу других галогенов (йода, брома и т. д.). Вторая реакция замещения — нитрование — проходит по похожему принципу. Здесь в роли катализатора выступает концентрированный раствор серной кислоты. Для проведения такого рода химической реакции к бензолу необходимо добавить нитратную кислоту (HNO 3), тоже концентрированную, в результате чего образуются нитробензол (C 6 H 5 NO 2) и вода. В этом случае атом гидрогена замещается группой из атома нитрогена и двух оксигена.

Реакции присоединения
Это второй тип химических взаимодействий, в которые способны вступать ароматические углеводороды. Они также существуют двух видов: галогенирование и гидрирование. Первая происходит только при наличии солнечной энергии, которая выступает в роли катализатора. Для проведения этой реакции к бензолу также необходимо добавить хлор, но в большем количестве, чем для замещения. На одну молекулу бензола должно приходиться три хлора. В результате получим гексахлорциклогексан (С 6 Н 6 Cl 6), то есть к имеющимся атомам присоединится еще и шесть хлора.
Гидрирование происходит только в присутствии никеля. Для этого необходимо смешать бензол и гидроген (Н 2). Пропорции те же, что и в предыдущей реакции. Вследствие этого образуется циклогексан (С 6 Н 12). Все остальные ароматические углеводороды также могут вступать в такого типа реакции. Они происходят по такому же принципу, как и в случае с бензолом, только с образованием уже более сложных веществ.
Получение химических веществ этой группы
Начнем все так же с бензола. Его можно получить с помощью такого реагента, как ацетилен (С 2 Н 2). Из трех молекул данного вещества под воздействием высокой температуры и катализатора образуется одна молекула нужного химического соединения.

Также бензол и некоторые другие ароматические углеводороды можно добыть из каменноугольной смолы, которая образуется во время производства металлургического кокса. К получаемым таким способом можно отнести толуол, о-ксилол, м-ксилол, фенантрен, нафталин, антрацен, флуорен, хризен, дифенил и другие. Кроме того, вещества этой группы часто добывают из продуктов переработки нефти.
Как выглядят разнообразные химические соединения этого класса?
Стирол представляет собой бесцветную жидкость с приятным запахом, малорастворимую в воде, температура кипения составляет +145 градусов по Цельсию. Нафталин — кристаллическое вещество, также мало растворяется в воде, плавится при температуре +80 градусов, а закипает при +217. Антрацен в нормальных условиях также представлен в виде кристаллов, однако уже не бесцветных, а имеющих желтую окраску. Это вещество не растворяется ни в воде, ни в органических растворителях. Температура плавления — +216 градусов по шкале Цельсия, кипения — +342. Фенантрен выглядит как блестящие кристалы, которые растворяются только в органических растворителях. Температура плавления — +101 градус, кипения — +340 градусов. Флуорен, как понятно из названия, способен к флуоресценции. Это, как и многие другие вещества данной группы, — бесцветные кристаллы, нерастворимые в воде. Температура плавления — +116, закипания — +294.

Применение ароматических углеводородов
Бензол используется при производстве красителей в качестве сырья. Также он применяется при получении взрывчатки, пестицидов, некоторых лекарств. Стирол используют в производстве полистирола (пенопласта) с помощью полимеризации исходного вещества. Последний широко применяют в строительстве: в качестве тепло- и звукоизолирующего, электроизоляционного материала. Нафталин, как и бензол, участвует в производстве пестицидов, красителей, лекарств. Кроме того, он используется в химической промышленности для получения многих органических соединений. Антрацен также применяют в изготовлении красителей. Флуорен играет роль стабилизатора полимеров. Фенантрен, как и предыдущее вещество и многие другие ароматические углеводороды, — один из компонентов красителей. Толуол широко применяют в химической промышленности для добывания органических веществ, а также для получения взрывчатки.

Характеристика и использование веществ, добываемых с помощью ароматических углеводородов
К таким в первую очередь можно отнести продукты рассмотренных химических реакций бензола. Хлорбензол, к примеру, является органическим растворителем, также используется в производстве фенола, пестицидов, органических веществ. Нитробензол является компонентом полировальных средств для металла, применяется при изготовлении некоторых краситлей и ароматизаторов, может играть роль растворителя и окислителя. Гексахлорциклогексан используется в качестве яда для борьбы с насекомыми-вредителями, а также в химической промышленности. Циклогексан применяют в производстве лакокрасочных изделий, при получении многих органических соединений, в фарамацевтической отрасли промышленности.

Заключение
Прочитав эту статью, можно сделать вывод, что все ароматические углеводороды имеют однотипную химическую структуру, что позволяет объединить их в один класс соединений. Кроме того, их физические и химические свойства также весьма похожи. Внешний вид, температуры кипения и плавления всех химических веществ данной группы не сильно отличаются. Свое применение многие ароматические углеводороды находят в одних и тех же отраслях промышленности. Вещества, которые можно получить вследствие реакций галогенирования, нитрования, гидрирования, также имеют схожие свойства и используются в похожих целях.
А РЕНЫ
Ароматические углеводороды (арены) – циклические углеводороды, объединяемые понятием ароматичности, которая обуславливает общие признаки в строении и химических свойствах.
Классификация
По числу бензольных колец в молекуле арены подразделяются на:
моноядерные
многоядерные

Номенклатура и изомерия
Структурным родоначальником углеводородов бензольного ряда служит бензол С 6 Н 6 от которого строятся систематические названия гомологов.
Для моноциклических соединений сохраняются следующие несистематические (тривиальные) названия:

Положение заместителей указывают наименьшими цифрами (направление нумерации не имеет значения),
|
|
|
а для ди замещенных соединений можно использовать обозначения орто, мета , пара.
|
|
|
|
Если в кольце три заместителя тони должны получить наименьшие номера, т.е. ряд «1,2,4» имеет преимущество перед «1,3,4».


1,2-диметил-4-этилбензол (верное название) 3,4-диметил-1-этилбензол (неверно)
Изомерия монозамещенных аренов обусловлена строением углеродного скелета заместителя, у ди- и полизамещенных гомологов бензола добавляется ещё изомерия, вызванная различным расположением заместителей в ядре.
Изомерия ароматических УВ состава С 9 Н 12:
|
|
|
|
|
Физические свойства
Температуры кипения и плавления у аренов выше, чем у алканов, алкенов, алкинов, малополярные, не растворимы в воде и хорошо растворимы в неполярных органических растворителях. Арены это жидкости или твердые вещества, имеющие специфические запахи. Бензолы и многие конденсированные арены токсичны, некоторые из них проявляют концерогенные свойства. Промежуточными продуктами окисления конденсированных аренов в организме являются эпоксиды, которые либо сами непосредственно вызывают рак, либо являются предшественниками канцерогенов.
Получение аренов
Многие ароматические УВ имеют важное практическое значение и производятся в крупном промышленном масштабе. Ряд промышленных способов основан на переработке угля и нефти.
Нефть состоит главным образом из алифатических и алициклических УВ, для превращения алифатических или ациклических УВ в ароматические разработаны способы ароматизации нефти, химические основы которых развиты Н.Д. Зелинским, Б.А. Казанским.
1. Циклизация и дегидрирование:
2. Гидродезметилирование:

3. Гомологи бензола получают путем алкилирования или ацилирования с последующим восстановлением карбонильной группы.
а) Алкилирование по Фриделю-Крафтсу:

б) Ацилирование по Фриделю-Крафтсу:

4. Получение бифенила по реакции Вюрца-Фитинга:
5. Получение дифенилметана по реакции Фриделя-Крафтса:
Строение и химические свойства.
Критерии ароматичности:
На основании теоретических расчетов и экспериментального изучения циклических сопряженных систем было установлено, что соединение ароматично, если оно имеет:
- Плоский циклический σ-скелет;
- Сопряженную замкнутую π-электронную систему, охватывающую все атомы цикла и содержащую 4n + 2, где n = 0, 1, 2, 3 и т.д. Эта формулировка известна, как правило Хюккеля. Критерии ароматичности позволяют отличать сопряженные ароматические системы от всех других. Бензол содержит секстет π-электронов и соответствует правилу Хюккеля при n = 1.
Что дает ароматичность:
Несмотря на высокую степень ненасыщенности, ароматические соединения устойчивы к действию окислителей и температуры, они более склонны вступать в реакции замещения, а не присоединения. Эти соединения обладают повышенной термодинамической стабильностью, обеспечивающейся высокой энергией сопряжения ароматической системы кольца (150 кДж/моль), поэтому арены предпочтительней вступают в реакции замещения, в результате чего сохраняют ароматичность.
Механизм реакций электрофильного замещения в ароматическом кольце:
Электронная плотность π-сопряженной системы бензольного кольца является удобным объектом для атаки электрофильными реагентами.
Как правило, электрофильные реагенты генерируются в процессе реакции при помощи катализаторов и соответствующих условий.
Е – Y → E δ + – Y δ - → E + + Y -
Образование π-комплекса. Первоначальная атака электрофилом π-электронного облака кольца приводит к координации реагента с π-системой и образованию комплекса донорно-акцепторного типа называемого π-комплекса. Ароматическая система не нарушается:

Образование σ-комплекса. Лимитирующая стадия, на ней электрофил образует ковалентную связь с атомом углерода за счет двух электронов π-системы кольца, что сопровождается переходом данного атома углерода из sp 2 - в sp 3 - гибридное состояние и нарушением ароматической, молекула превращается в карбокатион.

Стабилизация σ-комплекса. Осуществляется путем отщепления от σ-комплекса протона с помощью основания. При этом за счет двух электронов разрывающейся ковалентной связи С – Н восстанавливается замкнутая π-системы кольца, т.е. происходит возврат молекулы в ароматическое состояние:

Влияние заместителей на реакционную способность и ориентацию электрофильного замещения
Заместители в бензольном кольце нарушают равномерность в распределении π- электронного облака кольца и тем самым оказывают влияние на реакционную способность кольца.
- Электронодонорные заместители (Д) повышают электронную плотность кольца и увеличивают скорость электрофильного замещения, такие заместители называют активирующими.
- Электроноакцепторные заместители (А) понижают электронную плотность кольца и уменьшают скорость реакции, называются дезактивирующими.
Бензол получают из каменноугольной смолы, образующейся при коксовании угля, нефти, синтетическими методами.
1. Получение из алифатических углеводородов . При пропускании алканов с неразветвленной цепью, имеющих не менее шести атомов углерода в молекуле, над нагретой платиной или оксидом хрома происходит дегидроциклизация — образование арена с выделением водорода : способ Б.А. Казанского и А.Ф. Платэ
2. Дегидрирование циклоалканов (Н.Д. Зелинский )Реакция происходит при пропускании паров циклогексана и его гомологов над нагретой платиной при 3000 0 .
3. Получение бензола тримеризацией ацетилена над активированным углём при 600 0 (Н.Д. Зелинский )
| 3НC?СН | -- 600?C ? |
4. Сплавление солей ароматических кислот со щелочью или натронной известью:
5. Химические свойства аренов.
Бензольное ядро обладает высокой прочностью. Для аренов наиболее характерны реакции, протекающие по механизму электрофильного замещения, обозначаемого символом S E (от англ. substitution electrophilic).
Химические свойства бензола.
1. Реакции замещения:
Галогенирование . Бензол не взаимодействует с хлором или бромом в обычных условиях. Реакция может протекать только в присутствии катализаторов — безводных АlСl 3 , FeСl 3 , АlВr 3 . В результате реакции образуются галогенозамещенные арены:
Роль катализатора заключается в поляризации нейтральной молекулы галогена с образованием из нее электрофильной частицы:
Нитрование . Бензол очень медленно реагирует с концентрированной азотной кислотой даже при сильном нагревании. Однако при действии так называемой нитрующей смеси (смесь концентрированных азотной и серной кислот) реакция нитрования проходит достаточно легко:
Сулъфирование . Реакция легко проходит под действием “дымящей” серной кислоты (олеума):
2. Алкилирование по Фриделю—Крафтсу . В результате реакции происходит введение в бензольное ядро алкильной группы с получением гомологов бензола. Реакция протекает при действии на бензол галогеналканов RСl в присутствии катализаторов — галогенидов алюминия. Роль катализатора сводится к поляризации молекулы RСl с образованием электрофильной частицы:
В зависимости от строения радикала в галогеналкане можно получить разные гомологи бензола:
Алкилирование алкенами. Эти реакции широко используются в промышленности для получения этилбензола и изопропилбензола (кумола). Алкилирование проводят в присутствии катализатора АlСl 3 . Механизм реакции сходен с механизмом предыдущей реакции:
Все рассмотренные выше реакции протекают по механизму электрофильного замещения S E . Реакции присоединения к аренам приводят к разрушению ароматической системы и требуют больших затрат энергии, поэтому протекают только в жестких условиях.
3. Реакции присоединения, идущие с разрывом связей :
Гидрирование . Реакция присоединения водорода к аренам идет при нагревании и высоком давлении в присутствии металлических катализаторов (Ni, Pt, Pd). Бензол превращается в циклогексан , а гомологи бензола — в производные циклогексана:
Радикальное галогенирование . Взаимодействие паров бензола с хлором протекает по радикальному механизму только под воздействием жесткого ультрафиолетового излучения. При этом бензол присоединяет три молекулы хлора и образует твердый продукт — гексахлорциклогексан (гексахлоран) С 6 Н 6 Сl 6:
4. Окисление кислородом воздуха. По устойчивости к действию окислителей бензол напоминает алканы. Только при сильном нагревании (400 °С) паров бензола с кислородом воздуха в присутствии катализатора V 2 О 5 получается смесь малеиновой кислоты и ее ангидрида:
5. Бензол горит. (Просмотр опыта) Пламя бензола коптящее из-за высокого содержания углерода в молекуле.
2 C 6 H 6 + 15 O 2 → 12CO 2 + 6H 2 O
6. Применение аренов.
Бензол и его гомологи применяются как химическое сырье для производства лекарств, пластмасс, красителей, ацетона, фенола, формальдегидных пластмасс. ядохимикатов и многих других органических веществ. Широко используются как растворители. Бензол в качестве добавки улучшает качество моторного топлива. Этилен используют для получения этилового спирта, полиэтилена. Он ускоряет созревание плодов (помидоров, цитрусовых) при введении незначительных количеств его в воздух теплиц. Пропилен используется для синтеза глицерина, спирта, для добывания полипропилена, который идет на изготовление веревок, канатов, упаковочного материала. Исходя из 1-бутену, добывают синтетический каучук.
Ацетилен используют для автогенной сварки металлов. Полиэтилен используются как упаковочный материал, для изготовления сумок, игрушек, домашней посуды (бутылок, ведер, мисок и т.п.). Ароматические углеводороды широко применяют в производстве красителей, пластических масс, химико-фармацевтических препаратов, взрывчатых веществ, синтетических волокон, моторного топлива и др. Основным источником получения А. у. служат продукты коксования каменного угля. Из 1 т кам.-уг. смолы можно в среднем выделит: 3,5 кг бензола, 1,5 кг толуола, 2 кг нафталина. Большое значение имеет производство А. у. из нефтяных углеводородов жирного ряда. Для некоторых А. у. имеют практическое значение чисто синтетические методы. Так, из бензола и этилена производят этилбензол, дегидрирование которого приводит к стиролу.
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ:
1. Какие соединения называются аренами?
2. Какие характерные физические свойства?
3. Задача. Из 7,8 г бензола получено 8,61 г нитробензола. Определите выход (в%) продукта реакции.
Понятие «бензольное кольцо» сразу требует расшифровки. Для этого необходимо хотя бы коротко рассмотреть строение молекулы бензола. Первая структура бензола была предложена в 1865 г. немецким ученым А. Кекуле:
К наиболее важным ароматическим углеводородам относятся бензол С 6 Н 6 и его гомологи: толуол С 6 Н 5 СН з, ксилол С 6 Н 4 (СН з) 2 и др.; нафталин C 10 H 8 , антрацен С 14 Н 10 и их производные.
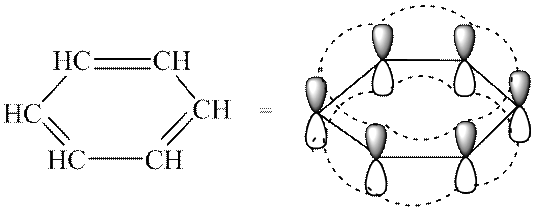
Атомы углерода в молекуле бензола образуют правильный плоский шестиугольник, хотя обычно его рисуют вытянутым.
Окончательно строение молекулы бензола подтверждено реакцией образования его из ацетилена. В структурной формуле изображается по три одинарных и три двойных чередующихся углерод-углеродных связей. Но такое изображение не передает истинного строения молекулы. В действительности углерод-углеродные связи в бензоле равноценны, и они обладают свойствами, не похожими на свойства ни одинарных, ни двойных связей. Эти особенности объясняются электронным строением молекулы бензола.
Электронное строение бензола
Каждый атом углерода в молекуле бензола находится в состоянии sp 2 -гибридизации. Он связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. В результате образуется плоский шестиугольник: все шесть атомов углерода и все σ-связи С-С и С-Н лежат в одной плоскости. Электронное облако четвертого электрона (р-электрона), не участвующего в гибридизации, имеет форму гантели и ориентировано перпендикулярно к плоскости бензольного кольца. Такие р-электронные облака соседних атомов углерода перекрываются над и под плоскостью кольца.

В результате шесть р-электронов образуют общее электронное облако и единую химическую связь для всех атомов углерода. Две области большой электронной плоскости расположены по обе стороны плоскости σ-связей.

p-Электронное облако обусловливает сокращение расстояния между атомами углерода. В молекуле бензола они одинаковы и равны 0,14 нм. В случае простой и двойной связи эти расстояния составили бы соответственно 0,154 и 0,134 нм. Значит, в молекуле бензола нет простых и двойных связей. Молекула бензола - устойчивый шестичленный цикл из одинаковых СН-групп, лежащих в одной плоскости. Все связи между атомами углерода в бензоле равноценны, чем и обусловлены характерные свойства бензольного ядра. Наиболее точно это отражает структурная формула бензола в виде правильного шестиугольника с окружностью внутри (I). (Окружность символизирует равноценность связей между атомами углерода.) Однако часто пользуются и формулой Кекуле с указанием двойных связей (II):

Бензольное ядро обладает определенной совокупностью свойств, которую принято называть ароматичностью.
Гомологический ряд, изомерия, номенклатура
Условно арены можно разделить на два ряда. К первому относят производные бензола (например, толуол или дифенил), ко второму - конденсированные (полиядерные) арены (простейший из них - нафталин):

Гомологический ряд бензола имеет общую формулу С n Н 2 n -6 . Гомологи можно рассматривать как производные бензола, в котором один или несколько атомов водорода замещены различными углеводородными радикалами. Например, С 6 Н 5 -СН 3 - метилбензол или толуол, С 6 Н 4 (СН 3) 2 - диметилбензол или ксилол, С 6 Н 5 -С 2 Н 5 - этилбензол и т.д.

Так как в бензоле все углеродные атомы равноценны, то у первого его гомолога - толуола - изомеры отсутствуют. У второго гомолога - диметилбензола - имеются три изомера, отличающиеся взаимным расположением метильных групп (заместителей). Это орто- (сокращенно о-), или 1,2-изомер, в нем заместители находятся у соседних атомов углерода. Если заместители разделены одним атомом углерода, то это мета- (сокращенно м-) или 1,3-изомер, а если они разделены двумя атомами углерода, то это пара- (сокращенно п-) или 1,4-изомер. В названиях заместители обозначаются буквами (о-, м-, п-) или цифрами.

Физические свойства
Первые члены гомологического ряда бензола - бесцветные жидкости со специфическим запахом. Плотность их меньше 1 (легче воды). В воде нерастворимы. Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Арены горят коптящим пламенем ввиду высокого содержания углерода в их молекулах.
Химические свойства
Ароматичность определяет химические свойства бензола и его гомологов. Шестиэлектронная π-система является более устойчивой, чем обычные двухэлектронные π-связи. Поэтому реакции присоединения менее характерны для ароматических углеводородов, чем для непредельных углеводородов. Наиболее характерными для аренов являются реакции замещения. Таким образом, ароматические углеводороды по своим химическим свойствам занимают промежуточное положение между предельными и непредельными углеводородами.
I. Реакции замещения
1. Галогенирование (с Cl 2 , Вr 2)

2. Нитрование

3. Сульфирование

4. Алкилирование (образуются гомологи бензола) - реакции Фриделя-Крафтса

Алкилирование бензола происходит также при его взаимодействии с алкенами:

Дегидрированием этилбензола получают стирол (винилбензол):

II. Реакции присоединения
1. Гидрирование

2. Хлорирование

III. Реакции окисления
1. Горение
2С 6 Н 6 + 15O 2 → 12СO 2 + 6Н 2 O
2. Окисление под действием КМnO 4 , К 2 Сr 2 O 7 , HNO 3 и др.
Не происходит химической реакции (сходство с алканами).
Свойства гомологов бензола
В гомологах бензола различают ядро и боковую цепь (алкильные радикалы). По химическим свойствам алкильные радикалы подобны алканам; влияние бензольного ядра на них проявляется в том, что в реакциях замещения всегда участвуют атомы водорода у атома углерода, непосредственно связанного с бензольным ядром, а также в более легкой окисляемости С-Н связей.

Влияние электронодонорного алкильного радикала (например, -СН 3) на бензольное ядро проявляется в повышении эффективных отрицательных зарядов на атомах углерода в орто- и пара-положениях; в результате облегчается замещение связанных с ними атомов водорода. Поэтому гомологи бензола могут образовывать тризамещенные продукты (а бензол обычно образует монозамещенные производные).








